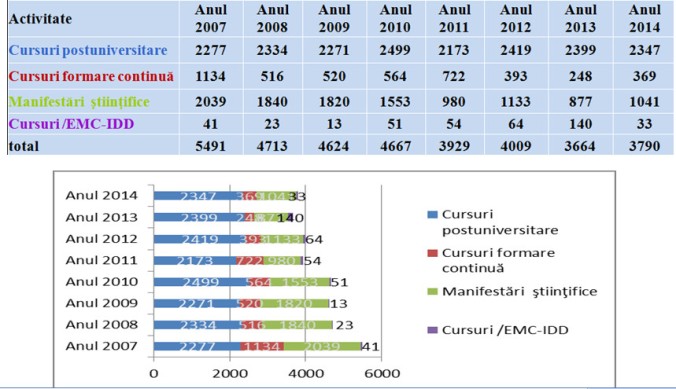
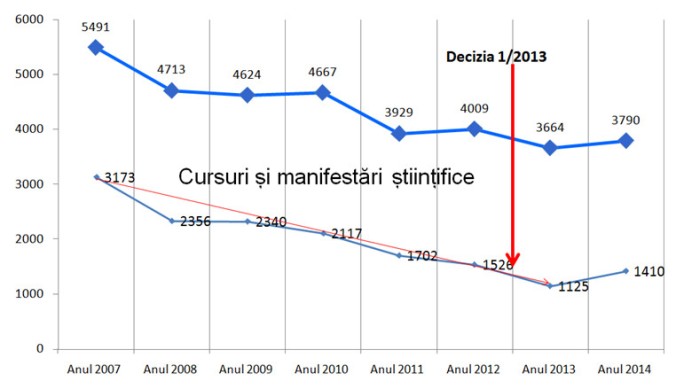
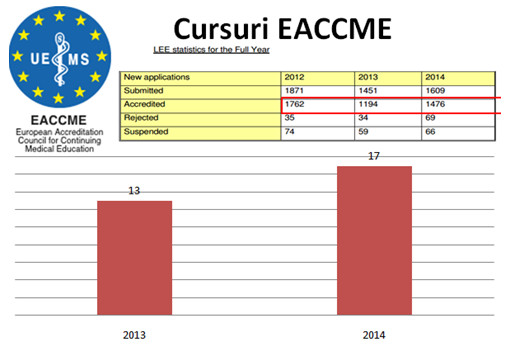
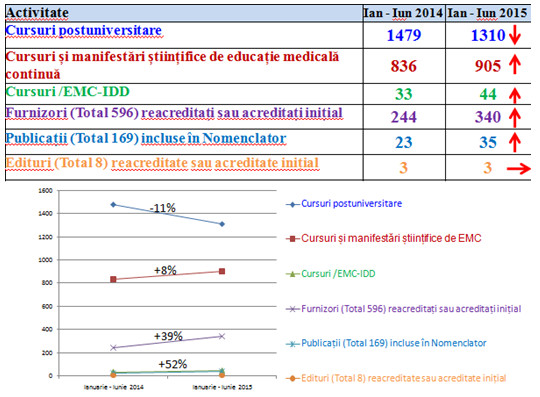
Golan Bubis1, Andrei Bumbuluț2, Bogdan Bumbuluț3
1St George University of London, Medical Program, Nicosia, Cyprus, 2Faculty of Medicine, ”Iuliu Haţieganu” University of Medicine and Pharmacy, Cluj Napoca, România, 3”Victor Papilian” Faculty of Medicine, ”Lucian Blaga” University, Sibiu, România
Abstract
Fish malodor syndrome or Fish Odor Syndrome (FOS) is a genetic disorder in which the patient emits a foul odor caused by trimethylamine. People with this syndrome cannot lead a normal social life and some suffer from clinical depression and suicidal thoughts. In this review the clinical biochemical and genetic features of the disorder are described, as well as the psychosocial sequels. The principles of therapy, including dietary, pharmacological and life style changes will also be discussed.
Keywords: Fish malodor syndrome, genetic disorder, trimethylamine, therapy
Abbreviations: FOS-fish odor syndrome, TMA- Trimethylamine, TMAO – Trimethylamine-oxide, TMAU-trimethylaminuria , FMO3-Flavin monooxygenase 3
Introduction
Claire, a young woman, suffered for years of a very unpleasant smell from her breath and body. People would shout at her to brush her teeth. People said she smelled of poo. She knew that they were thinking: ‘she doesn’t wash’, although she washed several times a day. She said it even forced her to quit her job as a care assistant in a residential home. Her life was miserable, she even contemplated suicide. However, after watching a television program about someone with FOS, Claire asked her GP to perform the investigations and was finally diagnosed with the disorder called fish odor syndrome or trimethylaminuria (TMAU). She was instructed to change her diet and make some other life style changes and now she does not omit the disgusting smell and she can lead a normal life (Daily Mail, 16 April 2012).
Her story prompted us to review the syndrome so that all our readers will be familiar with it and diagnose and treat their patients as early as possible.
Historical review
The clinical syndrome was first described in the medical literature by Hubert JA et al., in 1970 [1]. Their patient, a six-year-old child, periodically had a marked fish-like smell which resulted from Trimethylamine (TMA) in her urine. They showed that the patient increased her urinary TMA by 67% after a 15 mg/kg oral dose of TMA, in contrast to the excretion by three control patients.
However this is not the first described case. Years earlier, Shakespeare in the play „the Tempest”, when Trinculo comes across the slave Caliban he wonders: „What have we here? A man or a fish? Dead or alive? A fish: he smells like a fish; a very ancient and fish-like smell; a kind of not of the newest Poor-John. A strange fish!” (William Shakespeare, The Tempest, Act 2, Scene 2, Trinculo’s monologue). This could indicate that this syndrome is not new.
Pathophysiology
FOS is a rare genetic condition in which the patient emits a foul odor, which resembles that of rotting fish. The substance responsible for the unpleasant smell is trimethylamine (TMA). TMA is normally formed in the intestine by bacterial action on choline or trimethylamine- Oxide. TMA passively diffuses across cell membranes and enters the hepatic circulation where it is oxidizes by Flavin monooxygenase 3 (FMO3) into the odorless Trimethylamine-oxide (TMAO). The disorder is most commonly caused by an inherited deficiency in FMO3, the vital enzyme for the metabolism of trimethylamine [2]. When TMA is not processed properly it can build up in the body. The excess TMA is released in a person’s urine, sweat and breath, and causes the odor characteristic of trimethylaminuria.
Genetics
Mutations in the FMO3 gene cause trimethylaminuria. Most cases appear to be inherited in an autosomal recessive pattern, which means that both copies of the gene in each cell are mutated. The parents of an individual with this condition each is a carrier of one copy of the mutated gene, but typically do not show signs and symptoms of the condition. Carriers of an FMO3 mutation, however, may have mild symptoms of trimethylaminuria or experience temporary episodes of strong body odor. They can also be diagnosed by loading a higher dose of TMA.
Diagnostic tests
After loading with 300 mg TMA orally, urine can be analyzed for the concentration of both TMA and TMAO, and the results may be given as an oxidizing ratio based on the formula TMAO/(TMAO+TMA)x100% [3]. A ratio of less than 84 percent should be observed in an affected individual with two FMO3 inactivating mutations. Loading of 600 mg Trimethylamine orally was found to distinguish between obligate carriers and normal subjects [4].
Incidence
Trimethylaminuria is listed as a „rare disease” by the Office of Rare Diseases (ORD) of the National Institutes of Health (NIH). This means that Trimethylaminuria, affects less than 200,000 people in the US population. Al-Waiz et al. [4] in a study of a random British white population group examined the ability to N-oxidize 600 mg of trimethylamine and showed that about 1% of the population was of possible carrier status. Mitchell et al. [5] explored Jordanian, Ecuadorian and New Guinean populations and found subjects with a relative deficiency in N-oxidation in all three groups, with 1.7% (2/116) Jordanian, 3.8% (3/80) Ecuadorian and 11.0% (11/100) New Guinean, excreting 80% or less of their total trimethylamine as the N-oxide. Between people with unexplained malodor Wiese et al. tested 353. One third of patients (118) tested positively for trimethylaminuria [6].
Treatment
There’s no cure for trimethylaminuria, but treatment aims to reduce trimethylamine levels in the body and control the symptoms.
- A special diet which is low in trimethylamine and in choline (which is converted to trimethylamine by gut bacteria) is recommended [7]. For instance avoiding foods such as fish, egg yolks, legumes, red meats, beans and other foods that contain choline, carnitine, nitrogn, sulfur and lecithin. The diet must be supervised by a dietician so that it will not cause any deficiency in necessary substances.
- A combination of antibiotics and probiotics is also used in order to reduce the numbers of trimethylamine-producing bacteria in the gut [8].
- The intake of dietary charcoal (total 1.5 g charcoal per day for 10 days) reduced the urinary free TMA concentration and increased the concentration of TMAO to normal values during charcoal administration. Copper chlorophyllin (total 180 mg per day for 3 weeks) was also effective at reducing free urinary TMA concentration and increasing TMAO to those of concentrations present in normal individuals. In the TMAU subjects examined, the effects of copper chlorophyllin appeared to last longer (i.e., several weeks) than those observed for activated charcoal. The results suggest that the daily intake of charcoal and/or copper chlorophyllin may be of significant use in improving the quality of life of individuals suffering from TMAU [9].
- The use of slightly acidic detergent with a pH between 5.5 and 6.5 is also recommended.
By these measures most patients can reduce their trimethylamine levels and lead normal social life.
Discussion
Trimethylaminuria (fish malodor syndrome) is a „benign” genetic condition; however it has major psychosocial sequelae [10]. The patients seem healthy, but the unpleasant odor they omit does not allow them to lead a normal social life. People take distance from them because they are disgusted by the smell. Many do not marry and do not have children. They have difficulty in finding a Job and supporting themselves. All this brings them to despair and to the need of psychiatric counselling and medications. Because many physicians are not familiar with the syndrome, patients with malodor don’t get the right diagnosis for many years and their misery is prolonged. However after receiving the correct diagnosis they can start a special diet and make other life style changes in order to reduce significantly the omitted odor and lead normal life. As mentioned previously 30% of patients complaining of unexplained malodor, test positively for TMAU, and can be helped. This is the GP’s obligation to make the correct diagnosis and instruct the patient of the proper diet and life style change.
References
- Humbert JA, Hammond KB, Hathaway WE. Trimethylaminuria: the fish-odour syndrome. Lancet 1970;10: 770-1.
- Messenger J, Clark S, Massick S, and Bechtel M. A Review of Trimethylaminuria: (Fish Odor Syndrome). J Clin Aesthet Dermatol 2013;6:45-8.
- Mackay RJ, McEntyre CJ, Henderson C, et al. Trimethylaminuria: causes and diagnosis of a socially distressing condition. Clin Biochem Rev 2011; 31:33-43.
- Al Waiz M, Ayesh R, Mitchell SC, Idle JR, Smith RL. Trimethylaminuria: the detection of carriers using a trimethylamine load test. J Inherit Metab Dis 1989;12:80-5.
- Mitchell SC, Zhang AQ, Barrett T, Ayesh R, Smith RL. Studies on the discontinuous N-oxidation of trimethylamine among Jordanian, Ecuadorian and New Guinean populations. Pharmacogenetics 1997;7:45-50.
- Wise PM, Eades J, Tjoa S, Fennessey PV, Preti G. Individuals reporting idiopathic malodor production: demographics and incidence of trimethylaminuria. Am J Med 2011;124:1058-63.
- Busby MG1, Fischer L, da Costa KA, Thompson D, Mar MH, Zeisel SH. Choline- and betaine-defined diets for use in clinical research and for the management of trimethylaminuria. J Am Diet Assoc 2004;104:1836-45.
- Treacy E, Johnson D, Pitt JJ, Danks DM. Trimethylaminuria, fish odour syndrome: a new method of detection and response to treatment with metronidazole. J Inherit Metab Dis 1995;18:306-12.
- Yamazaki H, Fuiieda M, Togashi M, et al. Effects of the dietary supplements, activated charcoal and copper chlorophyllin, on urinary excretion of trimethylamine in Japanese trimethylaminuria patients. Life Sci 2004;(16)74:2739-47.
- Mountain H, Brisbane JM, Hooper AJ, Burnett JR, Goldblatt J. Trimethylaminuria (fish malodor syndrome): a „benign” genetic condition with major psychosocial sequelae. Med J Aust 2008;189:468.